鉅大LARGE | 點擊量:6908次 | 2018年10月05日
常用的鋰離子電池參數的計算公式介紹
(1)電極材料的理論容量
電極材料理論容量,即假定材料中鋰離子全部參與電化學反應所能夠提供的容量,其值通過下式計算:
其中,法拉第常數(F)代表每摩爾電子所攜帶的電荷,單位C/mol,它是阿伏伽德羅數NA=6.02214×1023mol-1與元電荷e=1.602176×10-19C的積,其值為96485.3383±0.0083C/mol
故而,主流的材料理論容量計算公式如下:
LiFePO4摩爾質量157.756g/mol,其理論容量為:
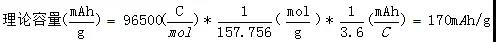
同理可得:三元材料NCM(1:1:1)(LiNi1/3Co1/3Mn1/3O2)摩爾質量為96.461g/mol,其理論容量為278mAh/g,LiCoO2摩爾質量97.8698g/mol,如果鋰離子全部脫出,其理論克容量274mAh/g.
石墨負極中,鋰嵌入量最大時,形成鋰碳層間化合物,化學式LiC6,即6個碳原子結合一個Li。6個C摩爾質量為72.066g/mol,石墨的最大理論容量為:
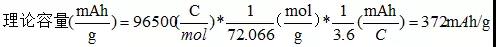
對于硅負極,由5Si+22Li++22e-?Li22Si5可知,5個硅的摩爾質量為140.430g/mol,5個硅原子結合22個Li,則硅負極的理論容量為:
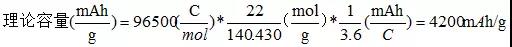
這些計算值是理論的克容量,為保證材料結構可逆,實際鋰離子脫嵌系數小于1,實際的材料的克容量為:材料實際克容量=鋰離子脫嵌系數×理論容量
(2)電池設計容量
電池設計容量=涂層面密度×活物質比例×活物質克容量×極片涂層面積
其中,面密度是一個關鍵的設計參數,主要在涂布和輥壓工序控制。壓實密度不變時,涂層面密度增加意味著極片厚度增加,電子傳輸距離增大,電子電阻增加,但是增加程度有限。厚極片中,鋰離子在電解液中的遷移阻抗增加是影響倍率特性的主要原因,考慮到孔隙率和孔隙的曲折連同,離子在孔隙內的遷移距離比極片厚度多出很多倍。
(3)N/P比
負極活性物質克容量×負極面密度×負極活性物含量比÷(正極活性物質克容量×正極面密度×正極活性物含量比)
石墨負極類電池N/P要大于1.0,一般1.04~1.20,這主要是出于安全設計,主要為了防止負極析鋰,設計時要考慮工序能力,如涂布偏差。但是,N/P過大時,電池不可逆容量損失,導致電池容量偏低,電池能量密度也會降低。
而對于鈦酸鋰負極,采用正極過量設計,電池容量由鈦酸鋰負極的容量確定。正極過量設計有利于提升電池的高溫性能:高溫氣體主要來源于負極,在正極過量設計時,負極電位較低,更易于在鈦酸鋰表面形成SEI膜。
(4)涂層的壓實密度及孔隙率
在生產過程中,電池極片的涂層壓實密度。
而考慮到極片輥壓時,金屬箔材存在延展,輥壓后涂層的面密度。
涂層由活物質相、碳膠相和孔隙組成,孔隙率。
其中,涂層的平均密度。
(5)首效
首效=首次放電容量/首次充電容量
日常生產中,一般是先化成再進行分容,化成充入一部分電,分容補充電后再放電,故而:
首效=(化成充入容量+分容補充電容量)/分容第一次放電容量
(6)能量密度
體積能量密度(Wh/L)=電池容量(mAh)×3.6(V)/(厚度(cm)*寬度(cm)*長度(cm))
質量能量密度(Wh/KG)=電池容量(mAh)×3.6(V)/電池重量
上一篇:簡述不同類型電池的標識
下一篇:什么是鋰離子電池電容器的工作原理

























